










Категория: Инструкции
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: Н2 S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: 2H2 O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например: Cl2 + H2 O → HClO + HCl
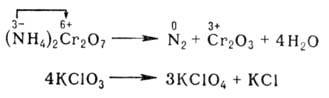
Репропорционирование (конпропорционирование, контрдиспропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления: HOCL + HCl → H2 O + Cl2
Увеличение кислотности приводит к увеличению электродного потенциала, следовательно, к увеличению окислительных свойств электрохимической системы. Напротив, уменьшение кислотности увеличивает восстановительные свойства электрохимических систем. Сказанное в первую очередь относится к системам, в которых окисленная и восстановленная форма содержат различное количество кислорода. В тех случаях, когда содержание кислорода в окисленной и восстановленной формах не меняется, влияние среды не столь велико. Это относится, например, к процессам: Cl2 + 2e = 2Cl–; Br2 + 2e = 2Br–; I2 + 2e = 2I–.
Для осуществления заданной окислительно-восстановительной реакции и более глубокого ее протекания необходима определенная кислотность раствора. Выбор среды (кислой или щелочной) можно сделать путем сравнения стандартной ЭДС реакций в кислой и щелочной средах. Оптимальной является та, в которой достигается большее значение ЭДС.
© studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам
Отрицательно заряженный электрод
Разрушение металла под действием окружающей среды
Частица, отдающая электроны
Элементарные частицы, переход которых обуславливает изменение степеней окисления в ходе ОВР
Заряд частиц, движущихся к аноду
1. ОВР — это реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества.
2. Восстановитель — это элемент или вещество, отдающее электроны. Само оно при этом окисляется.
Окислитель – это элемент или вещество, принимающее электроны. Само оно при этом восстанавливается.

3. Некоторые активные окислители:

4. Некоторые активные восстановители:

1. Самым сильным восстановителем среди элементов IVA группы является:
4) свинец
Обоснуйте свой выбор.
Т. к. восстановительные свойства в группе сверху вниз усиливаются, то в 4 группе самым сильным восстановителем будет свинец – он ниже всех остальных.
2. Наиболее слабым окислителем среди элементов VA группы является:
2) сурьма
Обоснуйте свой выбор.
Т. к. окислительные свойства элементов в группе сверху вниз ослабевают и ниже всех сурьма, то она будет самым слабым окислителем.
3. Окислительная активность галогенов возрастает от иода к фтору, потому что:
4) увеличивается их электроотрицательность
4. Максимальное значение степени окисления хлор проявляет в соединении, формула которого:
3) Сl2O7
5. Наименьшую степень окисления сера проявляет:
3) в сульфиде калия
6. Наименьшую степень окисления хром имеет в соединении:
1) Сг203
7. Окислительно-восстановительная реакция возможна между:
4) CuO и C
Запишите уравнение ОВР и составьте электронный баланс.

8. Сера проявляет восстановительные свойства в реакции, схема которой:

9. Рассмотрите взаимодействие алюминия с соляной кислотой:

10. Верны ли следующие суждения?
А. Сероводород проявляет только восстановительные свойства.
Б. Серная кислота проявляет как окислительные, так и восстановительные свойства.
2) верно только А
Обоснуйте свой ответ.
Сероводород (H2S) не может быть окислителем, т. к. сера в данном соединении имеет минимальную степень окисления -2, ее внешний энергетический уровень полностью заполнен электронами, т. е. она уже больше не в состоянии принимать электроны, она может только отдавать их (проявляет только восстановительные свойства) .
H2SO4 не может быть восстановителем, т. к. сера в данном соединении имеет максимальную степень окисления +6, на внешнем энергетическом уровне нет ни одного электрона, т. е. она может только принимать электроны, но не отдавать их (проявляет только окислительные свойства).
Окислительно-восстановительные реакции (ОВР)
окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя), например:
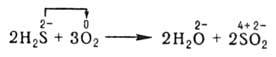
При этом окислитель восстанавливается, а восстановитель - окисляется. При протекании реакций в гальваническом элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса ΔG в данной реакции может быть превращено в полезную работу. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно.
При окислительно-восстановительных реакциях атомы в высшей степени окисления являются только окислителями, в низшей - только восстановителями; атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями. Многие окислительно-восстановительные реакции (ОВР) - каталитические (см. Окислительно-восстановительный катализ).
По формальным признакам окислительно-восстановительные реакции (ОВР) разделяют на межмолекулярные (например, 2SO2 + O2 → SO3 ) и внутримолекулярные, например:
Последняя реакция представляет собой самоокисление-самовосстановление (см. Диспропорционирование ).
окислительно-восстановительные реакции (ОВР) часто сопровождаются высоким энерговыделением, поэтому их используют для получения теплоты или электрической энергии. Наиболее энергичные окислительно-восстановительные реакции (ОВР) протекают при взаимодействии восстановителей с окислителями в отсутствие растворителя; в растворах такие реакции могут быть невозможны вследствие окислительно-восстановительного взаимодействия одного или обоих реагентов с растворителем. Так, в водном растворе нельзя непосредственно провести реакцию 2Na + F2 → 2NaF, поскольку натрий и фтор бурно взаимодействуют с водой. На окислительно-восстановительные свойства ионов сильно влияет комплексообразование, например: комплекс [Co 2+ (CN)6 ] 4-. в отличие от гидратированного иона Со 2+. является сильным восстановителем.
В случае окислительно-восстановительных реакций в органической химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при незначительно полярности связей между атомами, участвующими в реакции. В органической химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от органического соединения к окислителю возрастает число (или кратность) кислородсодержащих связей (С — О, N — О, S — О и т.п.) либо уменьшается число водородсодержащих связей (С — Н, N —Н, S —Н и т.п.), например: RCHO → RCOOH; R2 CHCHR2 → R2 C=CR2. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы, например: R2 CO → R2 CH2 ; RSO2 Cl → RSO2 H.
Используют также подход, при котором атомам С в молекуле приписывают различные степени окисления в зависимости от числа связей, образованных с элементом более электроотрицательным, чем водород. В этом случае функциональные производные можно расположить в порядке возрастания их степени окисления. Так, насыщенные углеводороды относят к нулевой группе (приблизительная степень окисления — 4), R2 C=CR2. ROH, RCl и RNH2 - к первой (- 2), RC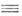 CR, R2 CO и R2 CCl2 - ко второй (0), RCOOH, RC
CR, R2 CO и R2 CCl2 - ко второй (0), RCOOH, RC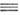 CCl, RCONH2 иRССl3 - к третьей (+2), RCN, CCl4 и СО2 - к четвертой (+4). Тогда окисление - процесс, при котором соединение переходит в более высокую категорию, а восстановление - обратный процесс.
CCl, RCONH2 иRССl3 - к третьей (+2), RCN, CCl4 и СО2 - к четвертой (+4). Тогда окисление - процесс, при котором соединение переходит в более высокую категорию, а восстановление - обратный процесс.
весьма разнообразны; реакции могут протекать как по гетеролитическому, так и по гомолитическому механизму. Во многих случаях начальная стадия реакции - процесс одноэлектронного переноса . Окисление обычно протекает по положениям с наибольшей электронной плотностью, восстановление - по положениям, где электронная плотность минимальна.
В органической химии используют широкий ряд восстановителей и окислителей, что позволяет выбрать реагент, обладающий селективностью (т.е. способностью действовать избирательно на определенные функциональные группы), а также получать продукты в требуемой степени окисления. Например, борогид Na восстанавливает кетоны или альдегиды до спиртов, не реагируя с амидами и сложными эфирами; LiAlH4 восстанавливает все эти соединения до спиртов. Среди окислителей высокой селективностью обладают, например, комплекс CrО3 с пиридином, с высоким выходом окисляющий спирты в кетоны, не затрагивая кратные связи С—С, а также SeO2. окисляющий кетоны и альдегиды до α-дикарбонильных соединений.
Селективность окислительно-восстановительных реакций может быть обеспечена и в каталитических процессах; например, в зависимости от катализатора и условий реакций ацетиленовые углеводороды можно селективно гидрировать до этиленовых или насыщенных углеводородов (см. Гидрирование ). Электрохимическое восстановление СО2 до СО в водной среде в присутствии никелевого комплекса 1,4,8,11-тетраазациклотетрадекана позволяет проводить желаемый процесс при более низких потенциалах и одновременно подавлять электролиз воды с образованием Н2. Эта реакция имеет ключевое значение для превращения СО2 через СО в разнообразные органические вещества.
Каталитические окислительно-восстановительные реакции (ОВР) играют важную роль в промышленности, например:

окислительно-восстановительные реакции (ОВР) широко распространены в природе и используются в технике. В основе жизни лежат окислительно-восстановительные реакции (ОВР), происходящие при фотосинтезе . дыхании, транспорте электронов; они же обеспечивают основную часть энергопотребления человечества за счет сжигания органического топлива. Получение металлов, извлечение энергии взрыва основано на окислительно-восстановительных реакциях.
Лит.: Хомченко Г.П. Севастьянова К.И. Окислительно-восстановительные реакции, 2 изд. М. 1980; Кери Ф. Сандберг Р. Углубленный курс органической химии, пер. с англ. кн. 2, М. 1981, с. 119-41, 308-43; Марч Дж. Органическая химия, пер. с англ. т. 4, М. 1988, с. 259-341; Турьяи Я.И. Окислительно-восстановительные реакции и потенциалы в аналитической химии, М. 1989; Тодрес З.В. Электронный перенос в органической и металлоорганической химии, в сб. Итоги науки и техники. Сер. Органическая химия, т. 12, М. 1989.
©С. И. Дракин, З.В. Тодрес.
Окислительно – восстановительные реакции
ОВР – реакции, протекающие с изменением степеней окисления элементов, образующих молекулы реагирующих веществ.
Процесс окисления – процесс отдачи электронов
Процесс восстановления – процесс принятия электронов
Окислитель – принимает электроны, восстанавливается и понижает степень окисления
Восстановитель – отдаёт электроны, окисляется и повышает степень окисления
1. Межмолекулярные – реакции, в которых атомы окислителя и восстановителя, входят в состав молекул различных исходных веществ.
2Cl - - 2e >Cl 2 0 (восстановитель окисляется)
Mn +4 + 2e >Mn +2 (окислитель восстанавливается)
2. Внутримолекулярные – реакции, в которых атомы окислителя и восстановителя, входят в состав молекулы одного и того же исходного вещества и являются атомами различных элементов или одного элемента, но с различной степенью окисления.
Cl +5 + 6e >Cl - ¦х 2 (окислитель восстанавливается)
2O -2 - 4e >O 2 0 ¦х 3 (восстановитель окисляется)
2N -3 - 6e >N 2 0 (восстановитель окисляется)
2N +3 + 6e >N 2 0 (окислитель восстанавливается)
3. Самоокисления-самовосстановления (диспропорционирования) – реакции, в которых атомы окислителя и восстановителя входят в состав одного и того же исходного вещества, являются атомами одного и того же элемента и имеют одинаковую степень окисления.
S +4 -2e >S +6 ¦x 3 (восстановитель окисляется)
S +4 + 6e >S -2 ¦x 1 (окислитель восстанавливается)
4. Контрпропорционирования – реакции, в которых атомы окислителя и восстановителя входят в состав различных исходных веществ, но являются атомами одного элемента в различной степени окисления, при этом образуются молекулы одного и того же продукта.
S +4 + 4e >S 0 ¦x 1 (окислитель восстанавливается)
S -2 – 2e >S 0 ¦x 2 (восстановитель окисляется)
Для подготовки к ЕГЭ: