










Категория: Бланки/Образцы
Отправлено 30 Ноябрь 2011 - 20:06
При нагревании бертолетовой соли в отсутствии катализатора ее распад одновременно идет по двум направлениям: а) с образованием кислорода; б) с образованием перхлората калия. Рассчитайте, сколько процентов бертолетовой соли разложилось по реакциям а) и б), если при полном разложении 73,5 г бертолетовой соли было получено 33,5 г хлорида калия.
Отправлено 30 Ноябрь 2011 - 21:49
объясните пожалуйста,как это решать?
Есть два пути разложения. По первому из KClO3 получаем кислород и KCl, т.е. весь хлор переходит из KClO3 в KCl. По второму из KClO3 получаем KCl и KClO4. т.е. далеко не весь хлор переходит в KCl, а один из 4. Вот и считаете, сколько теоретически должно получиться KCl из бертолетовой соли, если будет только первый путь разложения. Логически рассуждая, 33,5 г хлорида калия (из условия) должны быть меньше этого самого теоретического значения. Недостаток - из-за второго механизма. И тут каждый недополученный моль KCl отвечает одному полученному молю KClO4. Но при этом при втором механизме на каждый полученный мол KClO4 получается 1/3 моля KCl и разлагается 4/3 моля KClO3. И значит, чтобы найти количество молей KCl, получившихся по первому механизму, надо от общего количества KCl отнять 1/3 числа молей в недостатке. Понятно?
Поскольку составителя интересуют не моли и даже не граммы, а проценты, то можно посчитать долю прореагировавшего по двум механизмам хлората через количества KCl. Примерно как и описано выше.
1. Пишем уравнение реакции и считаем, сколько молей KCl получится из 73,5 г бертолетовой соли при первом механизме разложения - это будет "теоретическое количество".
2. А в условии сказано, что получили 33,5 г хлорида калия. Пересчитываем это в моли - делим на молярную массу, записываем переменную "получили" = 33,5/М. И тут мы вводим переменную "недостача" = "теоретическое количество" - "получили".
3. "Недостача" в молях - это число молей получившегося перхлората или 3/4 числа молей хлората, разложившегося по второму механизму. Значит, число молей бертолетовой соли, разложившейся по 2 механизму (обозначим как "число 2"), равно (4/3)*"недостача".
4. Соответственно, число молей перхлората, разложившегося по 1 механизму (обозначим его как "число 1"), определяется так: "число 1" = "получили" - (1/3)*"недостача".
5. Процент KClO3. прореагировавший по 1-му механизму, равен "число 1"/"теоретическое количество"
6. Процент KClO3. прореагировавший по 2-му механизму, равен "число 2"/"теоретическое количество"
Отправлено 30 Ноябрь 2011 - 22:25
n(KClO4)=73.5/122.5=0.6 моль
получили моль KCl: 33.5/74.5=0.5 моль
недостача" = "теоретическое количество" - "получили
недостача=0,6-0,5
недостача=0,1 моль
число молей бертолетовой соли, разложившейся по 2 механизму: 4/3*0.1=0.13 моль
проценты первого: 0,466/0.6*100%=77%
второго: 0.13/0.6*100%=21.6
а в ответах:66,7 и 33,3 %
в чем у меня тогда ошибка?
Отправлено 01 Декабрь 2011 - 02:24
KClO3 - KCl
X - Y
Y = X*KCl/KClO3
KClO3 - 0.25KCl
(73.5-X) - Z
Z = (73.5-X)*(0.25*KCl)/KClO3
X*KCl + (73.5-X)*(0.25*KCl) = 33.5*KClO3
0.75*X*KCl = 33.5*KClO3 - 18.375*KCl
X = (33.5*KClO3 - 18.375*KCl)/(0.75*KCl)
X/73.5 = 0.666 = 66.6%
Бесцветный газ без запаха и вкуса. При нормальных условиях 1 л O2 весит 1,42895 г. Пл. газа (по воздуху) 1,1053. Пл. жидкого кислорода 1,158 г/см 3 (при -186 °С). Т. пл. -218,8, т. кип. -182,97 °С. Очень мало растворим в воде (0,031 объема в 1 объеме воды при 20 °С).
Кислород быстро поглощается щелочным раствором пирогаллола и кислыми растворами солей двухвалентного хрома. Расплавленное серебро растворяет почти 10 объемов O2. выделяя его при затвердевании.
Кислород энергично поддерживает горение, поэтому в атмосфере чистого O2 горят такие вещества, которые не удается зажечь на воздухе (железо и др.).
1. Небольшие количества кислорода удобнее всего получать термическим разложением KClO3 в присутствии катализатора (MnO2 или Fe2O3 ):
KClO3 и катализатор не должен содержать примеси горючих веществ (уголь, бумага и т. д.), возможен сильный взрыв. Полезно предварительно прокалить небольшую порцию реакционной смеси в металлической ложке, чтобы убедиться, что кислород выделяется спокойно (незначительные искорки, появляющиеся в смеси не представляют опастности).
Смесь из 1 вес. ч. KClO3 и 0,5 вес. ч. катализатора загружают в большую пробирку или колбочку и нагревают горелкой. Выделяющийся кислород может содержать незначительную примесь хлора, от которого его легко очистить, пропуская газ через раствор KOH.
2. Препарат можно получить также при термическом разложении перманганата калия:
Нагревание проводят аналогично KClO3 (см. п. 1).
Если необходимо получить кислород, не содержащий даже следов азота и инертных газов, то рекомендуется предварительно нагреть KMnO4 в вакууме при 120 °С для удаления адсорбированных газов, затем отключить вакуумный насос и повысить температуру до начала разложения KMnO4. Из 318 г KMnO4 получается 17 л чистого кислорода.
3. Кислород можно получить путем каталитического разложения перекиси водорода:
Грубо измельченную MnO2 (ч.) отсевают от пыли и помещают в средний шар аппарата Киппа на подостланный волокнистый асбест. Аппарат заполняют раствором, который готовят, прибавляя при охлаждении 150 мл H2 SO4 (пл. 1,84) к 1 л 3%-ной H2 O2. Выделяющийся кислород довольно чист. При работе с малыми количествами вместо аппарата Киппа можно использовать колбу Эрленмейера.
4. Чистый кислород можно получить также по методике, основанной на каталитическом разложении H2 O2 при погружении в реакционный раствор платинированной никелевой пластинки *1 ; меняя глубину погружения, можно регулировать скорость разложения. Пластинку предварительно прокаливают в токе водорода до светло-серого цвета поверхности.
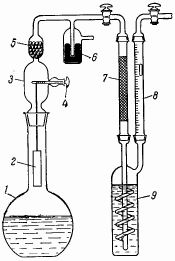
Процесс рекомендуется проводить в приборе, схема которого изображена на рис. 24. К реакционной колбе 1 емкостью 500 мл присоединяют насадку 3 со стеклянной поворачивающейся на шлифе пробкой-ворот 4. К этой пробке на тонкой (0,1 мм) платиновой проволоке подвешивают платинированную никелевую пластинке 2, свернутую в цилиндр. Вращая пробку 4, можно погружать пластинку в реакционный раствор на большую или меньшую глубину. Колбу заполняют 30%-ной перекисью водорода (техн.). Первые порции кислорода загрязнены воздухом, поэтому их отбрасывают. Далее выделяется очень чистый газ, содержащий лишь брызги H2 O2. Для очистки газ пропускают через трубку 5, заполненную стеклянными бусами, и через платинированную медную сетку 7. Сушат газ в промывной склянке 9 с конц. H2 SO4. Реакция прекращается, когда концентрация H2 O2 упадет до 1,5%.
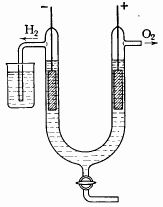
5. Чистый свободный от азота кислород, можно получить электролизом растворов щелочей или кислородных кислот. Электролиз рекомендуется проводить в стеклянной U-образной трубке *2 (рис. 25) внутренним диаметром 40-50 мм с цилиндрическими из никелевой жести или лучше из платины электродами при напряжении 10 В. Электролитом может служить 30%-ный раствор NaOH, 20%-ная H2 SO4 (при использовании платиновых электродов), 20%-ный раствор CrO3 в 10%-ной H2 SO4 или насыщенный раствор KMnO4 в 10%-ной H2 SO4 .
Если кислород должен выходить из прибора под давлением более 20-30 мм вод. ст, то трубку, отводящую водород погружают на некоторую глубину в стакан с водой, чтобы создать равное давление во втором колене прибора.
Для очистки выделяющийся кислород пропускают через стеклянную вату для удерживания брызг, затем через нагретый до 400 °С платинированный асбест для контактного окисления следов водорода. Если применяют никелевые электроды, покрытые слоем черной NiO, то выделяющийся кислород не содержит H2 .
Этот же прибор может применяться для получения H2 .
При повторном пользовании прибором следует особо внимательно проверить, на перепутаны ли полюса.
6. Продажный сжатый кислород (в стальных баллонах) достаточно чист и его можно применять для большинства лабораторных работ. Полезно промывать его растворами KMnO4. KOH и конц. H2 SO4. Примесь N2 обычно не мешает.
*1 Для патинирования никелевую пластинку опускают в 1-2%-ный раствор H2 [PtCl6 ] и присоединяют к отрицательному полюсу аккумулятора напряжением 4 В. В качестве анода используют кусок платиновой проволоки. Через 10-15 мин пластинку вынимают из электролита и промывают водой.
*2 Чмутов К. В. Техника физико-химического исследования. М. Госхимиздат, 1954. См. с. 174.
 Среди известных латинских изречений одно из самых популярных - «Dumspiro,spero» – «Пока дышу – надеюсь». С древних времен понятие «дыхание» теснейшим образом было связано с понятием «жизнь». Большинство живых существ для дыхания использует кислород. Химически активный кислород участвует и в других процессах, например, горении.
Среди известных латинских изречений одно из самых популярных - «Dumspiro,spero» – «Пока дышу – надеюсь». С древних времен понятие «дыхание» теснейшим образом было связано с понятием «жизнь». Большинство живых существ для дыхания использует кислород. Химически активный кислород участвует и в других процессах, например, горении.
Из всего сказанного ясно: кислород постоянно потребляется в огромных количествах. Однако его массовая и объёмная доли в воздухе относительно постоянны. Это объясняется тем, что запасы кислорода постоянно пополняются живыми организмами – растениями в результате фотосинтеза органических веществ.
Кислород – самый распространенный на Земле химический элемент: атмосфера нашей планеты содержит около 21% кислорода, в гидросфере на долю этого элемента приходится 89% от общей массы, в литосфере – 49%.
 Рассмотрим кислород с позиции имеющихся у нас химических знаний. Кислород, как химический элемент, находится во втором периоде и 6 группе Периодической системы химических элементов. Его порядковый номер 8. Относительная атомная масса кислорода 16. Во всех соединениях кислород проявляет валентность II.
Рассмотрим кислород с позиции имеющихся у нас химических знаний. Кислород, как химический элемент, находится во втором периоде и 6 группе Периодической системы химических элементов. Его порядковый номер 8. Относительная атомная масса кислорода 16. Во всех соединениях кислород проявляет валентность II.
В природе кислород распространен как в виде простых веществ – кислород состава О2 и озон состава О3 . имеющих первостепенное значение для существования жизни на Земле, так и в составе огромного количества органических и неорганических веществ, например, вода Н2 О. углекислый газ СО2 . карбонат кальция СаСО3 и другие.
Относительная молекулярная масса кислорода 32.
При нормальных условиях кислород – бесцветный газ без вкуса и запаха, при температуре –183 0 С превращается в голубоватую жидкость, при температуре –218 0 С – в синие кристаллы. Растворимость кислорода невелика и составляет около 5 г в 100 г воды при 0 0 С. Жидкий кислород хранят и транспортируют в металлических сосудах Дьюара или в специальных цистернах – танках. Кислородные баллоны окрашены в голубой цвет.
§2. Способы получения кислородаСуществует три способа получения кислорода:
1) путём разложения химических соединений кислорода при нагревании – термическое разложение;
2) посредством разложения воды электрическим током;
3) разделением воздуха на составные части.
Раньше других был изобретён химический способ получения кислорода из его соединений.
Один из наиболее простых и доступных его вариантов – нагревание перманганата калия. При этом происходит реакция (термическое разложение), сущность которой может быть выражена следующим уравнением:
2 моль перманганата калия разлагается с образованием 1 моль манганата калия, 1 моль оксида марганца (IV) и 1 моль кислорода.

Для определения особенностей устройства прибора, в котором будем получать кислород, рассчитаем относительную плотность кислорода по воздуху, которая равна отношению относительных молекулярных масс кислорода и воздуха. 32 ? 29 = 1,1.
Итак, кислород немного тяжелее воздуха. Значит, его можно собрать в сосуд методом вытеснения воздуха – кислород будет собираться на дне сосуда. Пробирку с нагреваемым перманганатом калия следует укрепить почти горизонтально.
Кислород весьма ограниченно растворяется в воде. Следовательно, собрать его можно также методом вытеснения воды.
§3. КатализаторыКислород можно получать также и разложением других соединений в присутствии катализаторов.
Катализаторами называются вещества, которые ускоряют ход химической реакции, но сами при этом не расходуются.
Реакции, протекающие с участием катализаторов, называются каталитическими.

Примером такой реакции является получение кислорода разложением бертолетовой соли - хлората калия, где катализатором служит оксид марганца ( IV ) МпО2.
Для интенсивного протекания реакции бертолетова соль должна быть нагрета до 400 0 С.
В присутствии катализатора – оксида марганца (IV) ее интенсивное разложение начинается уже при 200 0 С.
Этот же катализатор ускоряет реакцию разложения пероксида водорода:
В присутствии катализатора реакция протекает без нагревания. Достаточно в стакан с раствором пероксида водорода добавить немного чёрного порошка катализатора (оксида марганца (IV)), как жидкость тотчас вспенивается вследствие бурного выделения кислорода.
Опыт разложения пероксида водорода даёт возможность убедиться в том, что катализатор не расходуется во время реакции. С этой целью следует отфильтровать смесь, оставшуюся после завершения реакции. На фильтре останется столько чёрного порошка МпО2. сколько его было взято для реакции. Более того, этот порошок пригоден для разложения следующих порций пероксида водорода или бертолетовой соли.
§4. Использование способов получения кислорода в промышленностиХимические способы получения кислорода малопроизводительны и дороги. Их применяют в основном в лабораторной практике для получения небольших количеств газа. Кроме того, получение кислорода путём термического разложения некоторых его соединений (хлоратов) используют в подводных лодках. Чаще в качестве промышленного получения кислорода используют реакцию разложения воды или разделяют воздух на составные части.
Для визуального оформления использовались источники:
Что такое хлорат калия?
Калиевую соль хлорноватой кислоты (одна из четырех кислородсодержащих кислот, образованных хлором: хлорноватистая — HClO, хлористая — HClO2, хлорноватая — HClO3 и хлорная — HClO4) принято называть хлорат калия, его формула — KClO3. Эта соль по внешнему виду представляет собой кристаллы (бесцветные), которые слабо растворяются в воде (при 20 ºС в 100 см3 воды растворяется всего 7,3 г соли), но с повышением температуры растворимость растет. Другое ее известное название — бертолетова соль. Молекулярная масса вещества составляет 122,55 атомных единиц массы, плотность - 2,32 г/см3. Соль плавится при 356 ºС, разлагается примерно при 400 ºС.
Открытие бертолетовой соли
Впервые (в 1786 году) хлорат калия получил французский химик Клод Бертолле. Он пропускал хлор через концентрированный горячий раствор гидроокиси калия. Уравнение реакции, по которому была получена соль, выглядит следующим образом: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O. В результате этой реакции хлорат калия выпадает в виде белого осадка. Так как он слабо растворяется в холодной воде, то легко отделяется от остальных солей при охлаждении раствора. С момента своего открытия бертолетова соль являлся наиболее распространенным и полезным продуктом из всех хлоратов. В настоящее время KClO3 выпускается в промышленных масштабах.
Бертолетова соль — сильный окислитель. При взаимодействии ее с концентрированной соляной кислотой (HCl) выделяется свободный хлор. Этот процесс описывается уравнением химической реакции: 6HCl + KClO3 → 3Cl↑ + KCl + 3 H2O. Как и все хлораты, это вещество сильно ядовито. В расплавленном виде KClO3 энергично поддерживает горение. В смеси с легко окисляющимися веществами (восстановителями), такими как сера, фосфор, сахар и другие органические вещества хлорат калия взрывается от удара или трения. Чувствительность к этим воздействиям усиливается в присутствии солей аммония и броматов. При осторожном (нагревание до 60 ºС) окислении калия хлората с кислотой щавелевой получают двуокись хлора, процесс протекает по уравнению реакции: 2KClO3 + H2C2O4 → K2CO3 + CO2 + H2O + 2ClO2. Окись хлора находит применение при отбеливании и стерилизации различных материалов (бумажной массы, муки и прочее), а также может быть использована для обесфеноливания сточных вод химических заводов.
Применение калия хлората
Из всех хлоратов бертолетова соль находит самое широкое применение. Она используется в производстве красителей, спичек (делают горючее вещество спичечной головки, сырьем является увлажненный хлорат калия по ТУ 6-18-24-84), фейерверков, дезинфицирующих средств, диоксида хлора. Из-за высокой опасности составов с хлоратом калия они практически не применяются в производстве взрывчатых веществ для промышленных и военных целей. Очень редко хлорат калия применяется в качестве инициирующего взрывчатого вещества. Иногда используется в пиротехнике, в результате получают цветнопламенные составы. Раньше соль применяли в медицине: слабые растворы этого вещества (KClO3) некоторое время применялись как антисептик для наружного полоскания горла. Соль в начале 20 века использовали для получения кислорода в лабораторных условиях, но из-за опасности экспериментов они были прекращены.
Получение калия хлората
Одним из следующих способов: хлорированием гидроокиси калия, в результате обменной реакции хлоратов с другими солями, электрохимическим окислением в водных растворах хлоридов металлов — может быть получена бертолетова соль. Получение ее в промышленных масштабах чаще осуществляют по реакции диспропорционирования гипохлоритов (солей хлорноватистой кислоты). Технологически процесс оформляют по-разному. Чаще в его основе лежит реакция между хлоратом кальция и хлоридом калия: Ca(ClO3)2 + 2KCl → 2KClO3 + CaCl2. Затем образовавшаяся бертолетова соль из маточного раствора выделяется методом кристаллизации. Также хлорат калия получают по модифицированному методу Бертолле при электролизе хлорида калия: образующийся при электролизе хлор взаимодействует с калия гидроксидом, образовавшийся гипохлорит калия KClO диспропорционирует затем на калия хлорат KClO3 и исходный калия хлорид KCl.
Разложение хлората калия
При температуре примерно 400 ºС происходит разложение бертолетовой соли. В результате выделяется кислород и перхлорат калия: 4KClO3 → KCl + 3KClO4. Следующая стадия разложения протекает при температуре от 550 до 620 ºС: KClO4 → 2O2↑ + KCl. На катализаторах (ими могут быть оксид меди CuO, оксид железа (III) Fe2O3 или оксид марганца (IV) MnO2) разложение протекает при более низкой температуре (от 150 до 300 ºС) и в одну стадию: 2KClO3 → 2KCl + 3O2.
Бертолетова соль является неустойчивым взрывоопасным химическим веществом, которое может взорваться при перемешивании, хранении (например, рядом с восстановителями на одной полке в лаборатории или в одном складском помещении), измельчении или других операциях. В результате взрыва может наступить увечье или даже последовать летальный исход. Поэтому при получении, использовании, хранении или транспортировке хлората калия должны соблюдаться требования ФЗ 116. Объекты, на которых организованы эти процессы, относятся к опасным производственным объектам.
18. Окислительно-восстановительные реакции (продолжение 1)
18.5. ОВР пероксида водорода
В молекулах пероксида водорода H2 O2 атомы кислорода находятся в степени окисления –I. Это промежуточная и не самая устойчивая степень окисления атомов этого элемента, поэтому пероксид водорода проявляет и окислительные, и восстановительные свойства.
Окислительно-восстановительная активность этого вещества зависит от концентрации. В обычно используемых растворах с массовой долей 20 % пероксид водорода довольно сильный окислитель, в разбавленных растворах его окислительная активность снижается. Восстановительные свойства для пероксида водорода менее характерны, чем окислительные, и также зависят от концентрации.
Пероксид водорода – очень слабая кислота (см. приложение 13), поэтому в сильнощелочных растворах его молекулы превращаются гидропероксид-ионы.
В зависимости от реакции среды и от того, окислителем или восстановителем является пероксид водорода в данной реакции, продукты окислительно-восстановительного взаимодействия будут разными. Уравнения полуреакций для всех этих случаев приведены в таблице 1.
Уравнения окислительно-восстановительных полуреакций H2 O2 в растворах
Среди окислительно-восстановительных реакций выделяют реакции дисмутации (диспропорционирования, самоокисления-самовосстановления).
Реакции дисмутации – ОВР, в которых часть атомов одного и того же элемента в одной и той же степени окисления восстанавливается, а часть – окисляется.
Примером известной вам реакции дисмутации является реакция хлора с водой:
В этой реакции половина атомов хлора(0) окисляется до степени окисления +I, а вторая половина восстанавливается до степени окисления –I:
Составим методом электронно-ионного баланса уравнение аналогичной реакции, протекающей при пропускании хлора через холодный раствор щелочи, например KOH:
и, следовательно, уравнение реакции
Аналогично разлагается при нагревании и хлорат калия KClO3. если разложение проводить в присутствии катализатора (MnO2 ): 2KClO3 = 2KCl + 3O2
В отсутствие катализатора протекает реакция дисмутации.
К группе внутримолекулярных ОВР относятся и реакции термического разложения нитратов.
Обычно процессы, протекающие при нагревании нитратов довольно сложны, особенно в случае кристаллогидратов. Если в кристаллогидрате молекулы воды удерживаются слабо, то при слабом нагревании происходит обезвоживание нитрата [например, LiNO3. 3H2 O и Ca(NO3 )2 4H2 O обезвоживаются до LiNO3 и Ca(NO3 )2 ], если же вода связана прочнее [как, например, в Mg(NO3 )2. 6H2 O и Bi(NO3 )3. 5H2 O], то происходят своего рода реакции " внутримолекулярного гидролиза" с образованием основных солей – гидроксид-нитратов [Mg(NO3 )OH и Bi(NO3 )2 OH], которые при дальнейшем нагревании могут переходить в оксид-нитраты <[Be4 (NO3 )6 O] и [Bi6 O6 ](NO3 )6 >, последние при более высокой температуре разлагаются до оксидов.
Безводные нитраты при нагревании могут разлагаться до нитритов (если они существуют и при этой температуре еще устойчивы), а нитриты – до оксидов. Если нагревание проводится до достаточно высокой температуры, или соответствующий оксид малоустойчив (Ag2 O, HgO), то продуктом термического разложения может быть и металл (Cu, Cd, Ag, Hg).
Несколько упрощенная схема термического разложения нитратов показана на рис. 5.
Примеры последовательных превращений, протекающих при нагревании некоторых нитратов (температуры приведены в градусах Цельсия):
Несмотря на сложность происходящих процессов, при ответе на вопрос, что получится при " прокаливании" (то есть при температуре 400 – 500 o С) соответствующего безводного нитрата, обычно руководствуются следующими предельно упрощенными правилами:
1) нитраты наиболее активных металлов (в ряду напряжений – левее магния) разлагаются до нитритов;
2) нитраты менее активных металлов (в ряду напряжений – от магния до меди) разлагаются до оксидов;
3) нитраты наименее активных металлов (в ряду напряжений – правее меди) разлагаются до металла.
Используя эти правила, следует помнить, что в таких условиях
LiNO3 разлагается до оксида,
Be(NO3 )2 разлагается до оксида при более высокой температуре,
из Ni(NO3 )2 помимо NiO может получиться и Ni(NO2 )2.
Mn(NO3 )2 разлагается до Mn2 O3.
Fe(NO3 )2 разлагается до Fe2 O3 ;
из Hg(NO3 )2 кроме ртути может получиться и ее оксид.
Рассмотрим типичные примеры реакций, относящихся к этим трем типам:
ОВР конмутации – ОВР, в которых происходит выравнивание степени окисления атомов одного и того же элемента, находившихся до реакции в разных степенях окисления.
Эти реакции могут быть как межмолекулярными, так и внутримолекулярными. Например, внутримолекулярные ОВР, протекающие при термическом разложении нитрата и нитрита аммония, относятся к реакциям конмутации, так как здесь происходит выравнивание степени окисления атомов азота:
При более высокой температуре (250 – 300 o С) нитрат аммония разлагается до N2 и NO, а при еще более высокой (выше 300 o С) – до азота и кислорода, и в том и в другом случае образуется вода.
Примером межмолекулярной реакции конмутации является реакция, протекающая при сливании горячих растворов нитрита калия и хлорида аммония:
Если проводить аналогичную реакцию, нагревая смесь кристаллических сульфата аммония и нитрата кальция, то, в зависимости от условий, реакция может протекать по-разному:
Первая и третья из этих реакций – реакции конмутации, вторая – более сложная реакция, включающая как конмутацию атомов азота, так и окисление атомов кислорода. Какая из реакций будет протекать при температуре выше 250 o С, зависит от соотношения реагентов.
Реакции конмутации, приводящие к образованию хлора, протекают при обработке соляной кислотой солей кислородсодержащих кислот хлора, например:
Также по реакции конмутации образуется сера из газообразных сероводорода и диоксида серы:
ОВР конмутации довольно многочисленны и разнообразны – к ним относятся даже некоторые кислотно-основные реакции, например:
Для составления уравнений ОВР конмутации используется как электронно-ионный, так и электронный баланс, в зависимости от того, в растворе протекает данная реакция или нет.
На катоде выделяется медь, на аноде – кислород, а в растворе накапливается серная кислота.
Ионы металлов, стоящих в ряду напряжений правее водорода. при электролизе растворов солей разряжаются .
В принципе ионы металлов, стоящих в ряду напряжений левее водорода, при электролизе водных растворов не должны разряжаться. В этих случаях должен был бы выделяться водород. Практически, из-за специфических особенностей разряда ионов водорода, при электролизе выделяются и более активные металлы.
Ионы металлов, стоящих в ряду напряжений между алюминием и водородом при электролизе растворов солей разряжаются вместе с водородом .
При этом, чем активнее металл, тем больше водорода выделяется, и тем большая часть электрической энергии расходуется бесполезно.
6. Электролиз раствора NiBr2 . Электроды графитовые. Катодное и анодное пространства разделены.
2Br – 2e – = Br2
Одновременно с этим на катоде выделяется водород, в растворе накапливаются гидроксид-ионы, и, как следствие, протекает побочная реакция образования нерастворимого гидроксида никеля.
Ионы металлов, стоящие в ряду напряжений до алюминия при электролизе не разряжаются.
7. Электролиз раствора Na2 SO4 . Электроды платиновые. Раствор перемешивается.
В этом случае на катоде разряжаются не ионы натрия, а ионы оксония (2H3 O + 2e – = H2 + 2H2 O), равновесие автопротолиза воды смещается, в катодном пространстве накапливаются гидроксид-ионы. Суммарное уравнение реакции в катодном пространстве: 2H2 O + 2e – = H2 + 2OH .
Так как раствор перемешивается, происходит реакция нейтрализации. В итоге получаем
то есть, реакцию электролиза воды. При электролизе воды для повышения ее электропроводности в нее специально добавляют соли с неразряжающимися катионами и анионами, что значительно ускоряет процесс электролиза.
8. Электролиз раствора CuSO4 . Анод медный.
В результате сложения уравнений полуреакций мы можем прийти к ошибочному выводу, что ничего не происходит. На самом деле эти полуреакции описывают реальный технологический процесс электролитического рафинирования (очистки) меди: с катода, содержащего примеси на анод переходят только ионы меди.