







Категория: Инструкции
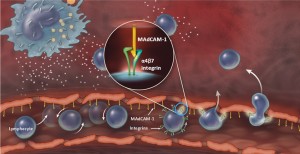
 Ведолизумаб (англ. vedolizumab ) — новейший лекарственный препарат, предназначенный для лечения средних и тяжёлых форм болезни Крона и язвенного колита. Представляет собой гуманизированное моноклональное антитело, которое связывается с интегрин-альфа-4-бета-7 – белком клеточной мембраны, ответственным за миграцию лейкоцитов в слизистую оболочку кишечника, тем самым снижая воспалительные процессы.
Ведолизумаб (англ. vedolizumab ) — новейший лекарственный препарат, предназначенный для лечения средних и тяжёлых форм болезни Крона и язвенного колита. Представляет собой гуманизированное моноклональное антитело, которое связывается с интегрин-альфа-4-бета-7 – белком клеточной мембраны, ответственным за миграцию лейкоцитов в слизистую оболочку кишечника, тем самым снижая воспалительные процессы.
20 мая 2014 года FDA допустило к применению в США, а 27 мая 2014 года CHMP (комитет Евросоюза) — к применению в ЕС единственный существующий в настоящее время препарат с действующим веществом ведолизумаб Entyvio.
В России ведолизумаб получил разрешения на применение 22 июня 2016 года под торговым наименованием Энтивио. Фирмы-разрабочик и производитель Энтивио (ведолизумаба) — Такеда Фармацевтикал (Takeda Pharmaceuticals), Япония и Такеда Фарма А/С, Дания.
Entyvio (ведолизумаб) — рецептурный препарат.
По АТХ ведолизумаб входит в группу «L04A Иммунодепрессанты » и имеет код L04AA33 (c 2015 года).
Категория риска по FDA действия ведолизумаба на плод — «B» (исследования на животных не выявили риски отрицательного воздействия на плод, надлежащих исследований у беременных женщин не было). Разрешения применения для лечения детей не имеет.
У ведолизумаба имеются противопоказания, побочные действия и особенности применения, необходима консультация со специалистом
В фармакологии лекарственные препараты принято разделять на синонимы и аналоги. В состав синонимов входит одно или несколько одинаковых активных химических веществ, оказывающих лечебное воздействие на организм. Под аналогами понимаются лекарства, содержащие разные активные вещества, но предназначенные для лечения одних и тех же болезней.

Причиной инфекционных заболеваний являются вирусы, бактерии, грибы и простейшие. Течение болезней, вызванных вирусами и бактериями зачастую схожи. Однако различить причину заболевания — значит подобрать правильное лечение, которое поможет быстрее справиться с недомоганием и не навредит ребенку.

Некоторым людям знакома ситуация, когда ребенок часто и долго болеет банальной простудой. Родители водят его по врачам, сдаются анализы, пьются лекарства, и в результате ребенок уже состоит на учете у педиатра как часто болеющий. Истинные же причины частых респираторных заболеваний оказываются не выявленными.

Хламидийный уретрит часто встречается в практике врача уролога. Его вызывает внутриклеточный паразит Chlamidia trachomatis, обладающий свойствами, как бактерий так и вирусов, что зачастую требует продолжительных (long term antibiotic therapy) схем лечения антибактериальными средствами. Он способен вызывать неспецифическое воспаление уретры у мужчин и женщин.
ООО «Такеда Фармасьютикалс» зарегистрировало первый на российском рынке инновационный препарат для лечения болезни Крона и язвенного колита – Энтивио (ведолизумаб).
Энтивио (ведолизумаб) станет первым на российском рынке биопрепаратом для лечения воспалительных заболеваний кишечника (ВЗК), к которым относятся болезнь Крона (БК) и язвенный колит (ЯК).
ВЗК занимают одну из ведущих позиций в структуре болезней пищеварительной системы, поскольку на сегодняшний день отсутствует специфическое лечение. Заболевания пищеварительной системы могут привести к развитию угрожающих жизни осложнений, необходимости проведения длительной, часто пожизненной, дорогостоящей терапии с неблагоприятным медико-социальным прогнозом.
В мире гастроэнтерологическими заболеваниями страдают более 5 млн человек, а расходы на лечение этих заболеваний превышают 30 млрд евро в год. Обычно ВЗК развивается у людей в трудоспособном возрасте (средний возраст заболевших – 20–40 лет).
«Появление Энтивио позволит расширить спектр возможностей терапии и избирательно воздействовать на иные мишени патогенеза воспалительных заболеваний кишечника», – заявил член комитета по стандартам Всемирного общества гастроэнтерологов и Европейской экспертной комиссии по воспалительным заболеваниям кишечника Игорь Халиф.
О намерении запустить пять оригинальных препаратов, в том числе Entyvio, на нескольких ключевых рынках компания Takeda сообщила в 2015 году.
Takeda Pharmaceutical – японская фармацевтическая компания, входящая в число 15 крупнейших в мире. Компания занимается разработкой препаратов для лечения метаболических расстройств, применения в области гастроэнтерологии, неврологии и онкологии. Центральный офис Takeda расположен в Осаке. Выручка за 2014-2015 финансовый год составила $16,5 млрд, а чистая прибыль – $735 млн.
Поделиться в соц.сетях
Обзор подготовила Евсютина Ю.В.
01 Октября 2013
Результаты третьей фазы рандомизированного двойного слепого плацебо-контролируемого исследования.
Болезнь Крона (БК) – хроническое воспалительное заболевание кишечника, основу терапии которого составляют глюкокортикостероиды, иммуносупрессивные препараты (азатиоприн, меркаптопурин и метотрексат) и антагонисты ФНО-α. Однако, не всегда удается добиться клинического ответа на терапию и довольно часто использование вышеперечисленных препаратов сопряжено с развитием побочных реакций.
Ведолизумаб (Takeda Pharmaceuticals) представляет собой гуманизированное моноклональное антилело, которое связывается с интегрин-альфа-4-бета-7 – белком клеточной мембраны, ответственным за миграцию лейкоцитов в слизистую оболочку кишки, и тем самым уменьшает воспалительный процесс.
Материалы и методы
Рандомизированное двойное слепое плацебо-контролируемое исследование проходило в 285 медицинских центрах 39 стран мира с декабря 2008 по май 2012 года. В исследование были включены 1115 пациентов с БК в возрасте от 18 до 80 лет, у которых сумма баллов по шкале Crohn's Disease Activity Index (CDAI) составляла от 220 до 450 (высокая степень активности), уровень С-реактивного белка (СРБ) был выше 2.87 мг/л, по данным колоноскопии выявлены более трех широких язв или 10 и более афтозных язв, уровень кальпротектина составлял более 250 мкг/г, и по данным КТ, МРТ, рентгенологического исследования тонкой кишки или капсульной эндоскопии выявлены язвы. У всех пациентов предыдущая терапия (глюкокортикостероиды, азатиоприн, меркаптопурин, метотрексати антагонисты ФНО-α) оказалась неэффективной. Пациенты во время проведения РКИ могли продолжить принимать назначенные им ранее препараты: преднизолон ≤30 мг или будесонид ≤9 мг в день, а также иммуносупрессивную терапию, месалазин и антибиотики в стандартных дозах. Критериями исключения являлись: наличие стомы, более 3-х резекций тонкой кишки в анамнезе, синдром короткой петли, кишечная стриктура, большая по объему резекция толстой кишки в анамнезе, абдоминальный абсцесс, туберкулез и злокачественные новообразования.
Пациенты были разделены на 2 когорты – когорта 1 – 368 пациентов (двойное-слепое исследование – получали ведолизумаб или плацебо) и когорта 2 - 747 пациентов – открытое исследование – получали ведолизумаб.
Ведолизумаб в дозе 300 мг или плацебо вводились внутривенно в 1 и 15 дни исследования.
В исследовании были 2 первичные конечные точки: первая – через 6 недель от начала терапии оценивалась клиническая ремиссия (сумма баллов по CDAI score ≤150 или уменьшение суммы баллов на 100 и более по сравнению с исходной), вторая - через 6 недель оценивалось изменение уровня СРБ.
В оценке поддерживающей терапии первичной конечной точкой считалась клиническая ремиссия через 52 недели от начала исследования, второй конечной точкой являлись: уменьшение суммы баллов по CDAI score, клиническая ремиссия без применения глюкокортикостероидов, длительная клиническая ремиссия (критерием оценки была ремиссия, зафиксированная врачами в ≥80% всех визитов).
Из 1115 пациентов, 220 получали ведолизумаб, 148 – плацебо (когорта 1) и 747 пациент получал ведолизумаб (когорта 2).
Через 6 недель в когорте 1 из 225 пациентов, принимавших ведолизумаб 32 (14,5%) и 10 (6,8%) пациентов из 148 (группа плацебо) имели клиническую ремиссию (P=0.02). Сумма баллов по CDAI score ≤150 или уменьшение суммы баллов на 100 и более имели место у 69 пациентов, принимавших ведолизумаб (31.4%) и у 38 (25.7%), получавших плацебо (P=0.23). В когорте 2 из 747 пациентов у 132 (17.7%) была клиническая ремиссия и у 257 (34.4%) было достоверное снижение суммы баллов по CDAI score.
В когорте 1 через 6 недель от начала исследования в группе, принимавших ведолизумаб и плацебо, отмечалась нормализация уровня СРБ.
Через 6 недель пациенты из любой когорты, ответившие на терапию ведолизумабом, были включены в исследование, направленное на изучение длительности поддерживающей терапии и принимали препарат каждые 8 недель (154 пациента), каждые 4 недели (n=154) или плацебо (n=153).
На 52 неделе в стадии клинической ремиссии находились 39,0% пациентов (60 из 154) получавших ведолизумаб каждые 8 недель, 36,4% (56 из 154) у которых введение препарата проводилось каждые 4 недели, и 21,6% (33 из 153), получавших плацебо.
На 52 неделе число пациентов, у которых был клинический ответ, оцененный по CDAI score и клиническая ремиссия без применения глюкокортикостероидов, было значительно больше в группе, принимавших ведолизумаб каждый 4 или 8 недель по сравнению с группой плацебо, тогда как число пациентов с продолжительным периодом ремиссии было практически одинаковым во всех группах.
В течение исследования назофарингит был диагностирован чаще у пациентов, принимавших ведолизумаб (12,3%), в то же время головная боль и боль в животе встречались чаще в группе плацебо.
Применение ведолизумаба по сравнению с плацебо было ассоциировано с большим риском развития инфекций – 44,1% и 40,2% и серьезных инфекции – 5,5% и 3,0% соответственно.
В течение первых 6 недель исследования у одной из пациенток, получавшей ведолизумаб, был диагностирован рак молочной железы.
Во время исследования по изучению эффективности поддерживающей терапии в группе пациентов, принимавших ведолизумаб, были диагностированы по одному случаю развития: туберкулеза, карциноидной опухоли аппендикулярного отростка, плоскоклеточного и базально-клеточного рака кожи. В группе пациентов, принимавших плацебо был зафиксирован один случай развития пограничной опухоли яичника.
Частота развития серьезных побочных эффектов была выше у пациентов, принимавших ведолизумаб (24,4%), чем при применении плацебо (15.3%).
За весь период исследования было зафиксировано пять смертей: четыре среди пациентов, принимавших ведолизумаб (причины: сепсис, преднамеренное употребление высокой дозы препаратов, миокардит и септический шок) и одна в группе плацебо - бронхопневмония.
За все время проведения исследования лишь у одного пациента развилась сильная местная реакция на внутривенное введение ведолизумаба, по причине которой, он был исключён из дальнейшего исследования.
За весь период исследования на введение ведолизумаба не зафиксировано ни одного случая анафилактического шока.
Через 6 недель пациенты с активной БК, получавшие ведолизумаб, в большем проценте случаев находились в стадии клинической ремиссии по сравнению с пациентами из группы плацебо, однако, существенных различий в оценке симптомов пациентов по шкале CDAI получено не было. Пациенты, ответившие на инициирующую терапию ведолизумабом, через 52 недели чаще находились в стадии клинической ремиссии по сравнению с пациентами, принимавшими плацебо. Побочные эффекты при использовании ведолизумаба встречались чаще чем в группе плацебо.
Источник: William J. Sandborn, M.D. Brian G. Feagan, M.D. Paul Rutgeerts, M.D. Ph.D. Stephen Hanauer, M.D. Jean-Frédéric Colombel, M.D. Bruce E. Sands, M.D. Milan Lukas, M.D. Ph.D. Richard N. Fedorak, M.D. Scott Lee, M.D. Brian Bressler, M.D. Irving Fox, M.D. Maria Rosario, Ph.D. Serap Sankoh, Ph.D. Jing Xu, Ph.D. Kristin Stephens, B.A. Catherine Milch, M.D. and Asit Parikh, M.D. Ph.D. Vedolizumab as Induction and Maintenance Therapy for Crohn's Disease. N Engl J Med 2013; 369:711-721August 22, 2013DOI: 10.1056/NEJMoa1215739.
Всероссийская образовательная интернет-программа для врачей
109029, Россия, Москва, ул. Нижегородская, д. 32, стр. 4, эт. 2, оф. 255открыть схему проезда +7 (495) 730-20-26
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Противоопухолевые средства — моноклональные антитела.
Характеристика вещества [ править ]Порошок или пористая масса белого или почти белого цвета.
Восстановленный раствор - от бесцветного до коричневато-жёлтого цвета, прозрачный или опалесцирующий раствор.
Фармакология [ править ]Ведолизумаб является иммуносупрессивным биологическим препаратом с селективным воздействием на кишечник. Он представляет собой гуманизированные моноклональные антитела IgG1. которые специфически связываются с ?4 ?7 -интегрином и селективно блокируют взаимодействие ?4 ?7 -интегрина с молекулами клеточной адгезии слизистой оболочки адрессином-1 (MAdCAM-1), но не с молекулами клеточной адгезии сосудов-1 (VCAM-1). MAdCAM-1 преимущественно экспрессируется, главным образом на клетках эндотелия кишечника, и играет ведущую роль в миграции Т-хелперных лимфоцитов, вызывающих хронический воспалительный процесс, характерный для язвенного колита и болезни Крона, при котором поражаются ткани желудочно-кишечного тракта (ЖКТ). Нарушение данного молекулярного взаимодействия препятствует трансмиграции кишечных Т-лимфоцитов через сосудистый эндотелий в паренхимную ткань у нечеловекообразных приматов и индуцирует обратимое трехкратное повышение содержания этих клеток в периферической крови. Мышиный прекурсор ведолизумаба уменьшал воспаление ЖКТ при колите у эдиповых тамаринов, которые являются экспериментальной моделью язвенного колита. Ведолизумаб не связывается с ?4 ?1 и ?E ?7 -интегринами, а также не подавляет их функцию.
У здоровых добровольцев, пациентов с язвенным колитом или у пациентов с болезнью Крона ведолизумаб не вызывал повышения содержания нейтрофилов, базофилов, эозинофилов, В-клеток и цитотоксических Т-лимфоцитов, общего количества хелперных Т-лимфоцитов памяти, моноцитов или натуральных клеток-киллеров в периферической крови при отсутствии лейкоцитоза.
Ведолизумаб не влиял на иммунный контроль и воспаление центральной нервной системы (ЦНС) при экспериментальном аутоиммунном энцефаломиелите у нечеловекообразных приматов, служащих моделью рассеянного склероза, а также на иммунные ответы при антигенной стимуляции кожи и мышц. Напротив, ведолизумаб подавлял иммунный ответ на желудочно-кишечную стимуляцию антигеном у здоровых добровольцев.
В клинических исследованиях пациентам вводили ведолизумаб в дозах от 2 до 10 мг/кг и наблюдали более чем 95%-ную сатурацию рецепторов ?4 ?7 на подтипах циркулирующих лимфоцитов, участвующих в иммунном надзоре в кишечнике.
Ведолизумаб не влиял на направленную миграцию CD4 + и CD8 + -лимфоцитов в ЦНС, о чем свидетельствует отсутствие изменений в отношении содержания CD4 + /CD8 + в спинномозговой жидкости у здоровых добровольцев до и после введения ведолизумаба. Эти данные согласуются с результатами исследований у нечеловекообразных приматов, которые указывают на отсутствие воздействия на иммунный контроль ЦНС.
Исследования фармакокинетики ведолизумаба с однократным и многократным введением проводились у здоровых добровольцев и у пациентов с тяжелым или среднетяжелым активным язвенным колитом или болезнью Крона.
У пациентов, получавших 300 мг ведолизумаба путем 30-минутной внутривенной инфузии в 0-ю и 2-ю неделю, средняя сывороточная концентрация на 6-й неделе составляла 27,9 мкг/мл (стандартное отклонение ±15,51) у пациентов с язвенным колитом и 26,8 мкг/мл (стандартное отклонение ± 17,45) у пациентов с болезнью Крона. Начиная с 6-й недели пациентам вводили ведолизумаб в дозах 300 мг каждые восемь недель или каждые четыре недели. У пациентов с язвенным колитом средняя стационарная сывороточная концентрация составляла 11,2 мкг/мл (стандартное отклонение ±7,24) и 38,3 мкг/мл (стандартное отклонение ± 24,43) соответственно. У пациентов с болезнью Крона средняя стационарная сывороточная концентрация составляла 13,0мкг/мл (стандартное отклонение ±9,08) и 34,8 мкг/мл (стандартное отклонение ± 22,55) соответственно.
Объем распределения ведолизумаба составляет около 5 литров. Препарат преимущественно находится в сыворотке и не распределяется в периферические ткани. Степень связывания ведолизумаба с белками плазмы не изучалась. Ведолизумаб представляет собой моноклональные антитела и, как ожидается, не должен связываться с белками плазмы. Ведолизумаб не проникает через гематоэнцефалический барьер после внутривенного введения. При внутривенном введении в дозе 450 мг ведолизумаб не определялся в цереброспинальной жидкости у здоровых добровольцев.
Общий клиренс ведолизумаба составляет примерно 0,157 л/сутки, а период полувыведения из сыворотки составляет 25 суток. Точный путь выведения ведолизумаба не установлен. Результаты популяционных анализов фармакокинетики дают основание полагать, что низкий уровень альбумина, повышенная масса тела, анамнез лечения препаратами-ингибиторами фактора некроза опухоли (ФНО) и наличие антител к ведолизумабу могут способствовать повышению клиренса ведолизумаба, но степень воздействия этих факторов не рассматривается как клинически релевантная. Дозирование ведолизумаба из расчета по массе тела не является обоснованным.
Ведолизумаб проявлял линейные фармакокинетические свойства при сывороточной концентрации более 1 мкг/мл.
Применение [ править ]Язвенный колит, болезнь Крона
Ведолизумаб: Противопоказания [ править ]Применение ведолизумаба в период беременности допустимо только в случае, если потенциальная польза явно превосходит предполагаемый риск как для матери, так и для плода.
Требуется соблюдать осторожность при применении ведолизумаба у женщин в период грудного вскармливания.
Ведолизумаб: Побочные действия [ править ]Частота нежелательных реакций препарата расценивается следующим образом:
Очень частые: ?1/10; частые: ?1/100, <1/10; нечастые: ?1/1000, <1/100; редкие: ?1/10 000, <1/1000; очень редкие: <1/10 000; частота неизвестна (не может быть рассчитана на основе имеющихся данных).
Инфекционные и паразитарные заболевания
Очень часто - назофарингит; часто - бронхит, гастроэнтерит, инфекции верхних дыхательных путей, грипп, синусит, фарингит; нечасто - инфекции дыхательных путей, вульвовагинальный кандидоз, кандидоз ротовой полости
Нарушения со стороны нервной системы
Очень часто - головная боль; часто - парестезия
Взаимодействие [ править ]Исследований совместного применения ведолизумаба с другими препаратами, включая биологические иммуносупрессанты, не проводилось. Таким образом, не рекомендуется смешивать приготовленный инфузионный раствор ведолизумаба с другими препаратами или вводить их в инфузионную систему.
Данные клинических исследований ведолизумаба у пациентов, ранее проходивших лечение с использованием натализумаба или ритуксимаба. отсутствуют.
Пациенты, ранее получавшие натализумаб. должны, как правило, выжидать не менее 12 недель, прежде чем начать лечение с использованием препарата, если клиническое состояние пациента не указывает иное.
Ведолизумаб: Способ применения и дозы [ править ]Препарат вводится пациентам в виде внутривенной инфузии (300 мг ведолизумаба) в течение 30 минут, затем в той же дозе через 2 недели и через 6 недель после первого введения, и далее каждые 8 недель.
Меры предосторожности [ править ]Перед началом лечения препаратом рекомендуется проведение вакцинации всех пациентов в соответствии с действующими рекомендациями по иммунизации.
Препарат следует применять под строгим наблюдением квалифицированного медицинского персонала, способного осуществить контроль реакций гиперчувствительности, включая анафилактическую реакцию. При проведении инфузии должны быть доступны средства неотложной помощи. Пациенты должны находиться под строгим наблюдением во время инфузии и после ее завершения в течение двух часов для первых двух инфузий, и примерно одного часа для последующих инфузий.
Прогрессирующая мультифокальная лейкоэнцефалопатия
Применение некоторых антагонистов интегрина и некоторых системных иммуносупрессорных препаратов ассоциируются с ПМЛ, оппортунистической инфекцией, вызываемой вирусом Джона Каннингема (JC). Синдром ПМЛ - это редкое демиелинизирующее заболевание ЦНС, возникающее в результате реактивации латентного JC-вируса, часто заканчивается летальным исходом. Связываясь с ?4 ?7 -интегрином, экспрессированным на мигрирующих в кишечник лимфоцитах, ведолизумаб оказывает иммуносупрессорное действие на ЖКТ. Развитие ПМЛ обычно происходит у пациентов с ослабленной иммунной системой.
Сообщения о случаях ПМЛ в клинических исследованиях ведолизумаба отсутствуют, но медицинским работникам следует проводить мониторинг пациентов, получающих ведолизумаб, на случай возникновения новых или ухудшения имеющихся неврологических признаков и симптомов, и рассмотреть возможность направления пациента к специалисту-неврологу. В случае подозрения на ПМЛ лечение ведолизумабом должно быть приостановлено, а в случае подтверждения диагноза лечение ведолизумабом полностью прекращают.
Условия хранения [ править ]При температуре 2-8 °С
Торговые наименования [ править ]Энтивио: концентрат для приготовления раствора для инфузий; Takeda Pharma A/S (Дания)
МКБ-10 [ править ]