



Категория: Бланки/Образцы
Российский кардиологический журнал № 2 (106) | 2014
каде наоборот, редуцируются высокочастотные волны (LF) [116].
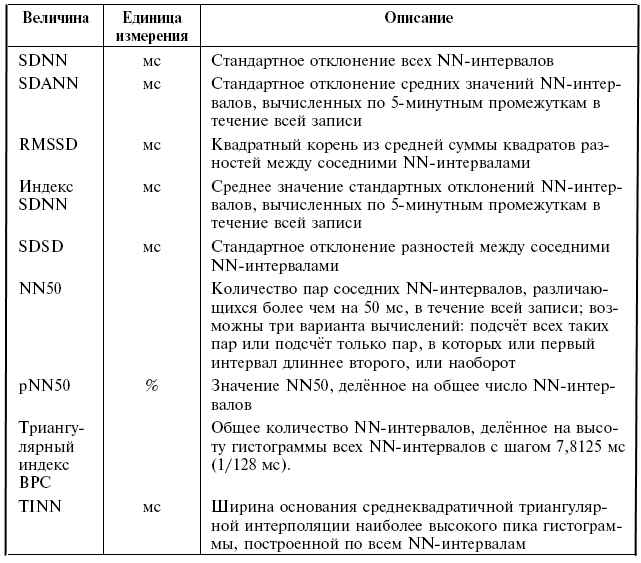
Результаты спектрального анализа могут быть представлены как в условных единицах (у. е.), так и в единицах мощности (мсек 2 ). Многие вопросы клинической интерпретации изменений ВРС при спектральном анализе не решены. Особенно это касается использования метода при оценке результатов ХМ. Эксперты American College Cardiology и American Heart Association рекомендуют использовать спектральный анализ только для оценки коротких, 5 минутных периодов записи, а не результатов ХМ [2]. С этим мнением согласны и многие другие специалисты, занимающиеся разработкой методов клинического анализа результатов ВРС и ХМ [128].
Связь временного и спектрального анализа показана в (табл. 20) [129].
Кратко резюмируя обзор двух основных современных методов оценки ВРС (временных и частотных) можно отметить, что оба метода дополняют друг друга и являются лишь различными математическими способами анализа одного и того же феномена. При применении методов оценки ВРС к результатам ХМ, преимуществом пользуется метод временного (time domain) анализа, как способ с более отработанными клиническими интерпретациями и менее зависящий от технических аспектов проведения исследования. Однако в современных системах ХМ в опции оценки ВРС включены, как правило, оба метода анализа, позволяющие комплексно подойти к оценке всех физиологических и патологических изменений сердечного ритма.
4.6. Новые технологии
В НИИ кардиологии им. А. Я. Мясникова, Г. В. Рябыкиной и А.В. Соболевым разработан новый метод оценки ВРС, основанный на оценке вариаций коротких участков ритмограммы (ВКРМ) и средневзвешенная вариация ритмограммы (СВВР) [132]. Прежде всего, авторы нового метода подвергают критическому анализу существующие (т. н. “рекомендованные”) параметры оценки ВРС в основных международных руководствах [2, 45], как не отражающие реального функционального состояния организма, а несущие только прогностическую информацию при критических значениях снижения ВРС, выявленных у больных с кардиальной патологией, прежде всего перенесших инфаркт миокарда [133].
По своей сути методы ВКРМ и СВВР также относится к временным (Time Domain) методам оценки ВРС. Особенностью методов является то, что для оценки ВРС используется не индивидуальные значения интервалов RR и их разности, а характеристики ритмограммы, полученные в результате усреднения величин интервалов RR и их разностей за сравнительно небольшие промежутки времени (20–40 сек).
При использовании данного метода, ритмограмма разбивается на короткие участки, содержащие одинаковое число интервалов RR, на которых оценивается ВРС с последующим статистическим анализом данных, полученных для всех коротких участков ритмограммы за рассматриваемый промежуток времени.
В качестве базовой характеристики для такого анализа используется т. н. вариация коротких участков ритмограммы. Использование данного метода, как и оценка усредненных индексов ВРС, предполагает устранение возможных случайных изменений ритма, артефактов, единичных эктопических комплексов. Если величина СВВР ниже определенных авторами нормативных параметров — это является отражением нарушения функциональных резервов сердечнососудистой системы. Метод апробирован в различных группах больных: ИБС, сердечная недостаточность, диабет и других [6].
Существует ряд важных новых технологий в оценке вариабельности ритма сердца, которые являются многообещающими для будущего. К ним относятся оценка турбулентности ритма сердца после желудочковых экстрасистол (ЖЭС) [131], AC/DC анализ и другие.
В 1999 году G. Schmidt и соавт. [134] разработали новый метод стратификации риска кардиоваскулярных больных, основанный на изменчивости RR интервалов до и после ЖЭС — турбулентность ритма сердца (ТРС). ТРС — это изменения ритма, развивающиеся в ответ
на возникающую тахиаритмию, заключающиеся в краткосрочных колебаниях частоты сердечных сокращений. Вслед за экстрасистолой возникает короткий период синусовой тахикардии, продолжительностью несколько циклов, сменяющийся более длительным эпизодом брадикардии и к 15–20 секунде частота ритма возвращается к исходным значениям. В основе этих изменений лежит барорефлекторная компенсация внутрисердечных гемодинамических изменений. Выделяют два независимых друг от друга параметра для анализа: турбулентность “onset” (ТО) — “начало” турбулентности, показатель, отражающий период тахикардии и турбулентность “slope” (TS) — “наклон” турбулентности, отражающий период брадикардии. ТО вычисляется, как отношение разницы двух последующих за экстрасистолой RR интервалов и 2-х предшествующих экстрасистоле RR интервалов, выраженная в процентах:
TO= (C+D) – (A+B) х100% (A+B)
где А и В 2 интервала RR, предшествующие желудочковой экстрасистоле, а C и D первые два интервала RR после постэкстрасистолической паузы. Параметр TS вычисляется, как максимальное позитивное значение наклона линии линейной регрессии, рассчитанное между значениями интервала RR (мсек) и последовательным номером интервала RR, в любых
Российский кардиологический журнал № 2 (106) | 2014
5. Холтеровское мониторирование у больных с нарушениями ритма сердца
5.1. Анализ аритмий
Как указывалось выше, каждое сокращение при ХМ классифицируется дешифратором как нормальное, эктопическое желудочковое, эктопическое суправентрикулярное, стимулированное, сливное, неизвестной природы, артефакт, залп тахикардии и другие. Обозначения несколько могут различаться в конкретной коммерческой системе ХМ. Для каждого вида аномалии создается матрица (лекало). Все классифицированные при ХМ классы аритмий должны быть оценены и подтверждены визуально опытным врачом, знающим особенности оценки аритмий при ХМ. Совместное руководство АСС/ АНА выделяет следующие возможные технические причины ложно-негативной или ложно-позитивной детекции и идентификации аритмий при ХМ [18]:
1. Неадекватный алгоритм компьютерной детекции и идентификации QRS комплексов;
2. “Шумы” и наводки, смещение электродов, артефакты;
3. Низкий вольтаж записи;
4. Дефекты записи вследствие нарушения скорости записи или записи на другой носитель;
5. Физиологическая вариабельность формы
и вольтажа QRS комплекса;
6. Неполное удаление или стирание предыдущей записи с ленты или из носителя (в настоящее время ленточные регистраторы практические не используются);
7. Неадекватная или некорректная техническая интерпретация в процессе анализа;
8. Некорректно маркированное время.
По результатам различных исследований, при ХМ у здоровых лиц суправентрикулярная экстрасистолия регистрируется в 51% у новорожденных; в 14–64% случаев у детей первого года жизни; 62% у детей 4–6 лет; 21% у детей 7–11 лет; 59% у детей 9–12 лет; 13% в 10–13 лет; в 57–77% случаев у детей 13–15 и у взрослых в 56% случаев [146–149]. При проведении ХМ у 102 здоровых детей 3–15 лет, суправентрикулярная экстрасистолия была выявлена только в 8,6% случаев [150]. У здоровых лиц желудочковая экстрасистолия в этих же исследованиях при ХМ регистрируется во всех возрастных группах [156]: в 18% у новорожденных; 6% детей первого года жизни; 8% детей 4–6 лет; в 14% случаев у детей 9–12 лет; в 27–57% случаев у подростков 13–15 лет и до 70% у взрослых. В некоторых исследованиях у здоровых лиц регистрируются единичные парные экстрасистолы и залпы желудочковой тахикардии не более трех сокращений подряд. Частота аритмии не превышала во всех исследованиях 20 экстрасистол в час.
В зависимости от максимальной представленности аритмии в суточном цикле выделяют дневной, ночной и смешанные циркадные типы (>70% аритмий в данный период времени). У больных с экстрасистолией смешанный циркадный тип аритмии является высокочувствительным (100%), хотя низкоспецифичным (18%) критерием парасистолии [151].
В количественной оценке необходимо указать общее количество экстрасистол и других эктопиче-
ских комплексов, их среднее количество в час и “плотность” аритмии в процентом отношении к синусовому ритму (в большинстве серийных систем — это автоматическая опция), т. к. в зависимости от частоты базового или возрастного ритма соотношение синусового и эктопического ритмов может существенно меняться при одном и том же абсолютном количестве эктопических комплексов.
В описательном ключе часто используется таблица градаций желудочковых аритмий Лауна
и Вольфа впервые используемую в палатах интенсивной терапии для прогноза больных с желудочковыми аритмиями [152] и их модификации. Несмотря на то, что клиническая значимость повышения градаций
и риска ВСС регулярно критикуется, в описательном
плане классификация давно стала классической и общепринятой формой для практического использования.
При брадиаритмиях (брадикардия, АВ блокады) одной из основных целей ХМ является выявление максимальных периодов брадиаритмии (снижения ЧСС и пауз ритма), наличия возможных дополнительных нарушений ритма сердца. ХМ является оптимальным методом выявления всего симптомокомплекса синдрома слабости синусового узла. Основными критериями нарушения функции синусового узла при ХМ у взрослых являются [153]:
1. Представленная постоянно, в течение 24 часов синусовая брадикардия с ЧСС <50 уд/мин;
2. Паузы ритма >3 сек в период бодрствования;
3. Постоянные или интермитирующие периоды симптомных выскальзывающих АВ ритмов;
4. Документированный синдром бради-тахи- кардии.
Максимальные брадиаритмии и паузы ритма при ХМ регистрируются в ночное время, чаще во вторую половину ночи [154]. Однако большее клиническое значение, очевидно, имеют внезапно возникающие симптомные брадиаритмии в период бодрствования.
Основными электрокардиографическими критериями прогностически неблагоприятного течения полной АВ блокады и риска возникновения синкопе или внезапной смерти вследствие приступов Мор ганьи-Адамса-Стокса является выявление при ХМ пауз ритма более 3 сек днем и удлинение выше нормы продолжительности интервала QT (так как синкопе
Российский кардиологический журнал № 2 (106) | 2014
енты, получавшие плацебо, у которых выявляется увеличение желудочковых преждевременных сокращений, имели более высокий показатель смертности, чем пациенты, у которых этого явления не наблюдалось [166]. Удлинение интервала QT, дисфункция синусового узла и появление, либо повышение степени АВ блокад также являются видами клинически значимых проаритмий. Оценка суточного тренда частоты аритмии, включенная во все системы ХМ, может помочь в формировании оптимальных схем терапии и хронотерапии [153, 167]. Рядом авторов исследована межсуточная вариабельность частоты
и типа аритмий, выявляемых в различных группах больных [21, 168–175]. Также имеются ограничения
и при долговременной воспроизводимости частоты
и типа желудочковых аритмий [176–181].
В исследовании CAST (исследование подавления сердечных аритмий) проверялась гипотеза, что подавление спонтанной эктопической активности с помощью антиаритмических лекарственных препаратов может привести к уменьшению смертности среди больных с бессимптомными желудочковыми аритмиями после ИМ [182–187]. Активными препаратами, использовавшимися в исследовании, были энкаинид, флекаинид и морицизин (этмозин). Всем пациентам была назначена лекарственная терапия и во время фазы индивидуального подбора дозы отслеживали путем мониторирования подавления спонтанной эктопической активности. Пациентам, у которых не было выявлено подавления аритмий, терапия назначалась без применения рандомизации. В этой группе смертность была в два раза выше, чем у пациентов, у которых аритмии подавлялись, и тех, которые были случайным образом отнесены в группу плацебо [182–185]. По сравнению с пациентами, получавшими плацебо, более высокая смертность в ходе долговре-
менного наблюдения, отмечалась и у
у которых имело место подавление
и которые в дальнейшем постоянно получали энкаинид и флекаинид. После получения этих результатов план исследования был изменен, и оно было продолжено с морицизином в качестве единственного активного препарата. Выявлена более высокая смертность во время плацебо-контролируемого подбора дозы морицизина [184]. Показано, что подавление спонтанных бессимптомных или малосимптомных желудочковых аритмий с помощью антиаритмического лекарственного препарата может быть не только неэффективным, но, по существу, вредным. Таким образом, у этих пациентов лечение антиаритмическими препаратами I класса в настоящее время не рекомендуется [187].
В ряде исследований оценивался эффект анти аритмических препаратов класса Ia, Ib и некоторых препаратов III класса [188, 189]. Было продемонстри-
ровано отсутствие, как положительного эффекта, так и побочных эффектов при антиаритмической лекарственной терапии. Исследования по эмпирическому применению амиодарона оказались противоречивыми. В некоторых исследованиях показана его эффективность [190–192], в других же не обнаружено существенного изменения смертности [193, 194].
В одном исследовании [195] амиодарон приводил к значительному подавлению частоты аритмии, но не влиял на показатели смертности.
Плацебо-контролируемые исследования анти аритмического лечения у пациентов с устойчивыми жизнеугрожающими желудочковыми аритмиями дают противоречивые результаты. Одно исследование, свидетельствующее в пользу такого лечения, показало увеличение выживаемости у больных без аритмии, которые ранее имели положительный ответ на антиаритмические препараты, зарегистрированный при ХМ [196, 197]. В этих наблюдениях невозможно установить эффект феномена “здоровый респондер”.
Проводилось сравнение ХМ с повторными электрофизиологическими исследованиями в 2 рандомизированных исследованиях у пациентов с устойчивыми желудочковыми аритмиями в анамнезе.
В работе Mitchell с соавт. [198] показано, что подход, основанный на электрофизиологическом исследовании, является лучшим; в то время как значительно более обширное исследование ESVEM (электрофизиологическое исследование против электрокардиографического мониторирования) показало отсут ствие различий в исходе при использовании двух подходов к выбору методов обследования [199]. Оба исследования имеют много существенных ограничений, и окончательные выводы об их значимости делать рано. Следует отметить, что в протокол ESVEM не был включен амиодарон, препарат, наиболее часто применявшийся у больных с тяжелыми аритмиями, оказавшийся эффективный у таких пациентов в нескольких недавно проведенных исследованиях по антиаритмической терапии [200, 201].
Swerdlow и Peterson [202] обнаружили при обследовании группы пациентов с ИБС и устойчивыми желудочковыми аритмиями, что у 76% пациентов имелись спонтанные желудочковые аритмии, подходящие для оценки лекарственной терапии в ходе 24-часового ХМ.
В 2 вышеупомянутых рандомизированных исследованиях, в которых сравнивали повторные ХМ с электрофизиологическим исследованием для подбора терапии, Mitchell с соавт. [198] и группа ESVEM [199] обнаружили, что соответственно 32% и 17% пациентов имели недостаточное количество нарушений ритма для их включения в анализ. Первое исследование проведено у пациентов, у которых имелась симптомная желудочковая аритмия, причем критерием для включения
Российский кардиологический журнал № 2 (106) | 2014
ской картины, в каждом конкретном случае, врач может обосновать необходимость проведения повторного исследования. При этом независимо от времени исследования, необходимо дать описание любому доступному для проведения расшифровки периоду записи. Для исключения пропуска опасных нарушений ритма сердца, образцы потенциально клинически значимых, но артефактных псевдоаритмий должны быть распечатаны с указанием критериев их артефактного генеза.
7. Холтеровское мониторирование в оценке возможных аритмогенных симптомов
7.1. Симптомные аритмии
В первую очередь наиболее широко ХМ применяется для определения связи преходящих симптомов у пациента с сердечными аритмиям [210, 211]. Некоторые симптомы, такие как: синкопальные и пресинкопальные состояния, головокружение и сердцебиение, часто обуславливаются преходящими аритмиями. Однако существуют и другие преходящие симптомы, которые реже связаны с нарушениями ритма: одышка, дискомфорт в груди, слабость, обильное потоотделение или неврологические симптомы, такие как транзиторные ишемические атаки. Необходим тщательный сбор анамнеза для определения необходимости проведения ХМ. Если предполагается, что аритмия является возможной причиной приходящей симптоматики у пациента, необходимую
решающую информацию дает регистрация ЭКГ в момент возникновения симптомов. При записи ЭКГ возможно сделать заключение, связана ли симптоматика с аритмией. При регистрации же ХМ возможно получить три варианта ответов. Во-первых, типичная симптоматика может иметь место одновременно с документально подтвержденной аритмией, способной вызвать указанные симптомы. Во-вторых, симптомы могут иметь место, когда при ХМ не регистрируется аритмий. В-третьих, у пациента могут отсутствовать какие-либо симптомы во время нарушений ритма, выявленных при мониторировании. Этот результат представляет сомнительную ценность. Бессимптомные аритмии являются частой находкой, даже в общей популяции у лиц без заболеваний сердца [212–215]. “Золотым стандартом” подтверждения или исключения аритмогенной природы симптомов является регистрация сердечного ритма одновременно с возникновением преходящих симп томов. Это может потребовать многократного 24-часового или 48-часового исследования или (особенно при нечастых симптомах) использования других видов мониторирования. [216, 217], прежде всего — имплантированных петлевых регистраторов (implantable loop recorder).
Иногда, особенно у пациентов с симптомами, возникающими при нагрузке, нагрузочный тест может быть более информативным в установлении связи между симптомами и сердечным ритмом. При жалобах на сердцебиение, не сопровождающихся гемодинамическими изменениями, синкопами или остановкой сердца, чреспищеводное электрофизиологическое исследование является более информативным, чем ХМ, а при ощущениях “провалов” или “остановок” ритма, типичных для экстрасистолии, синоатриальных пауз, более информативно ХМ [218]. Если симптомы тяжелы, может возникнуть необходимость
в проведении непрерывного мониторирования в стационарных условиях методом телеметрии. При сравнении ценности различных методов диагностики
в выявлении природы редко возникающих (<1/мес) непродолжительных (<1 мин) сердцебиений у лиц без органического поражения миокарда в исследовании
RUP (Recurrent Unexplained Palpitations) Giada F. и соавт. [219] определили большую диагностическую ценность имплантируемых петлевых регистраторов (73%) по сравнению с традиционными методами (ХМ, наружные событийные регистраторы, ЭФИ), которая составила 23% (р<0,001). Несмотря на начальную более высокую стоимость прибора и его имплантации, имплантируемые петлевые регистраторы (ИПР) оказались в итоге более экономически выгодным, чем традиционная стратегия диагностики.
7.2. Выбор метода регистрации
У большинства пациентов симптомы не повторяются в период мониторинга, истинный результат ХМ при обмороке может быть ниже 1–2% в неотобранной популяции. По данным E. Bass и соавт. [220] у 15% пациентов симптомы не были связаны с аритмией. Постоянная регистрация ХМ может быть особенно полезной у пациентов, имеющих полную потерю сознания и не способных в момент синкопе прикрепить и включить регистратор событий. Также она может быть полезна, если симптомы возникают ежедневно или практически ежедневно, хотя у большинства пациентов обычно симптомы не возникают столь часто. Такое мониторирование должно включать дневник пациента, где фиксируются возникающие симптомы, характер активности, а также использование кнопки тревоги. Кнопка тревоги нажимается всякий раз, когда у пациента возникает типичная симптоматика, что облегчает установление временной точки возникновения симптомов в процессе мониторирования. Обычно проводится 24-часовое мониторирование, хотя результаты могут быть несколько лучше при использовании более длительной или повторной записи [220]. У многих пациентов симптомы имеют место раз в неделю или месяц, в этом случае постоянная регистрация ХМ, возможно, не будет результативной. Записывающее

Российский кардиологический журнал № 2 (106) | 2014
нительную ценность постоянной записи. Имеется недостаточно данных относительно пресинкопальных состояний и головокружений по оценке чувствительности и специфичности ХМ в этих случаях [242].
Присутствие некоторых бессимптомных значимых аритмий, определяемых длительной асистолией (>3 сек), частой суправентрикулярной тахикардией (>160 уд/мин), или ЖТ рассматриваются некоторыми авторами как диагностическая находка, не всегда ассоциированная с синкопе [243–245]. Отсутствие документированной аритмии во время синкопе позволяет исключить аритмию, как механизм обморока [246]. У пациентов >40 лет с повторным обмороком, без значительной органической патологии сердца и нормальной ЭКГ, аритмия, обычно асистолия, присутствует во время обморока в 50% [247–250].
7.4. Событийные регистраторы для выявления причин симптомов
Событийные регистраторы — это внешние устройства, которые активируются самим пациентом, при возникновении симптомов. Эти системы могут быть весьма эффективны для выявления причин сердцебиений [221], но их роль в оценке синкопе невелика.
7.4.1. Наружные петлевые регистраторы (НПР) в диагностике синкопе
Данные приборы фиксируют ЭКГ с помощью типичных для ХМ или модифицированных наружных регистраторов, фиксирующих ЭКГ в режиме “петли” или “кольца”, непрерывно записывая и удаляя ЭКГ, если во время заданного времени “петли” (20–30 мин и тд.) не произошла активация записи. При активизации пациентом записи, обычно после возникновения симптома, ЭКГ сохраняется и может быть восстановлена для анализа. Предыдущие исследования показали противоречивые результаты о полезности наружных кольцевых регистраторов: одно исследование показало, что НПР позволяли зарегистрировать ЭКГ при обмороке до 25% включенных в исследование пациентов [251], наблюдаемых в течение 1 месяца, тогда как в другом исследовании [252] НПР не были полезны. Недавнее исследование показало, что у НПР были лучшие диагностические результаты при сравнении с традиционным ХМ [253]. Однако, так как пациенты обычно не привлекаются больше, чем на несколько недель, корреляция симптом-ЭКГ не может быть достигнута, когда обморок повторяется нечасто.
7.4.2. Имплантируемые петлевые регистраторы
В оригинале устройства называются implantable loop recorder (ILR) — в руccкой литературе: имплантируемые петлевые регистраторы (ИПР). ИПР ставятся подкожно под местной анестезией и имеют срок службы до 36 месяцев. У этих устройств есть
микроэлементная кольцевая память, которая хранит ретроспективную запись ЭКГ, когда активизируется или пациентом или свидетелем, обычно после синкопального эпизода [254, 255], или автоматически в случае возникновения запрограммированных аритмий [256, 257]. Некоторые из этих устройств имеют возможность передачи сигналов по телефону. Преимущества ИПР включают непрерывную кольцевую высокочастотную регистрацию ЭКГ. Неудобства включают: потребность в минимальной хирургической процедуре, трудность дифференцировки между наджелудочковой или желудочковой аритмиями, высокая стоимость вживляемого устройства. Однако если корреляция симптом-ЭКГ может быть достигнута у существенного числа пациентов во время работы устройства, анализ стоимости посредством результата корреляции симптом-ЭКГ показал, что имплантируемое устройство может быть более рентабельным, чем стратегия, использующая обычное исследование [258, 259].
В небольшом ряду отобранных пациентов корреляция симптом-ЭКГ была достигнута у 88% пациентов в пределах в среднем 5 месяцев после имплантации [254]. Объединенные данные девяти исследований [247, 255, 260–266], включающие 506 пациентов с необъясненным обмороком в конце полного обычного исследования, показали, что корреляция между обмороком и ЭКГ была найдена у 176 пациентов (35%); из них у 56% была выявлена асистолия (или брадикардия
в нескольких случаях) во время зарегистрированного случая, у 11% была тахикардия и у 33% не было никакой аритмии. Объединенные данные десяти исследований предобморочных состояний [247, 255, 260–264, 266–268] были гораздо менее вероятными, чтобы быть связанными с аритмией, чем при обмороке. Эти данные предполагают, что
в отсутствие зарегистрированной аритмии, предобморок нельзя рассматривать как замену обморока; напротив, регистрация существенной аритмии во время предобморока может быть рассмотрена как диагностическая находка.
Результативности диагностики при помощи ИПР посвящено несколько мультицентровых исследований. Одно из них — XPECT (Reveal XT Performance Trial) проводилось в 24 центрах США, Западной Европы, Канады, России и завершилось в 2010 году [269]. Исследование показало высокую результативность ИПР в выявлении аритмических событий и особенно, фибрилляции предсердий в сопоставлении с 48-часовым 12-канальным ХМ. Результативность детекции ФП при помощи ИПР составила 98,5%, диагностическая чувствительность — 96,1%, диагностическая специфичность — 85,4%, позитивная предсказательная ценность — 79,3%, негативная предсказательная ценность — 97,4%. Показатель